الایزا
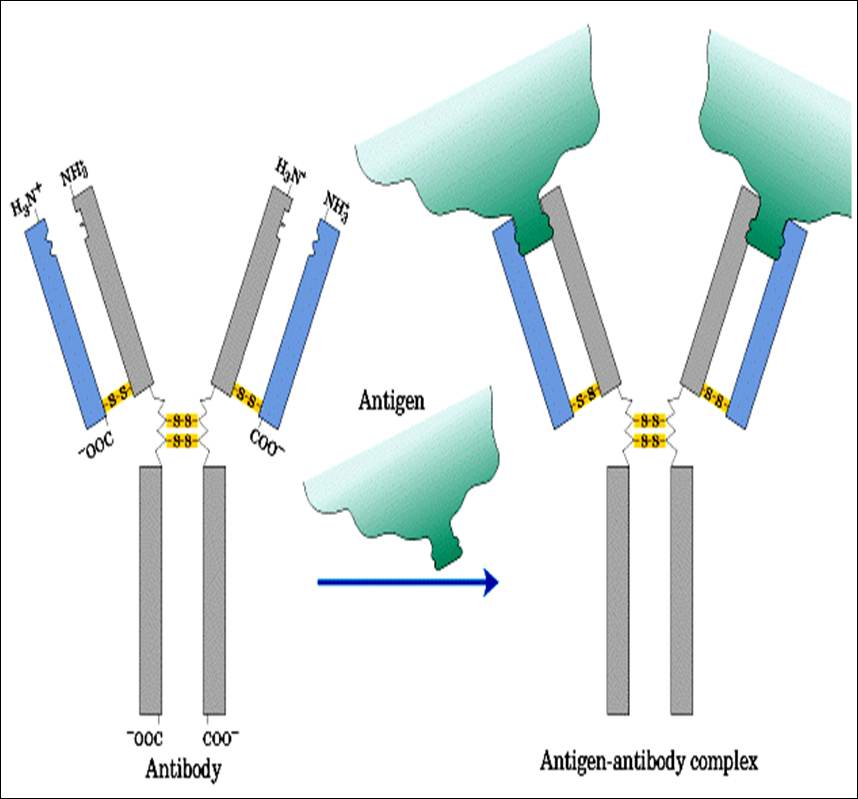
Enzyme linked Immune Sorbent Assay (ELISA) یک تکنیک بیوشیمیایی است که در ایمونولوژی برای مشخص و تائید کردن حضور آنتی بادی و یا آنتی ژن در یک نمونه بکار میرود. ELISA به عنوان یک ابزار تشخیص بیماری در پزشکی و پاتولوژی گیاهی و همچنین به عنوان کنترل کیفیت در مقاطع مختلف صنعت استفاده میشود. به زبان ساده در این روش مقادیر ناشناخته ای از آنتی ژن به یک سطح جامد متصل شده و سپس آنتی بادی خاص روی این سطح جامد شستشو میشود که قادر به برقراری باند با آنتی ژن است. این آنتی بادی به آنزیمی متصل شده و در مرحله نهایی ماده ای اضافه میشود که آنزیم را قادر به ایجاد سیگنال میسازد. بنابراین، ترکیب آنتی ژن/آنتی بادی، سیگنالی ایجاد میکند که به وسیلة آن میزان آنتی ژن موجود در نمونه قابل اندازه گیری است. هدف از تست الایزا بررسی اتصال یک آنتی بادی با حساسیت بالا با آنتی ژن مورد نظر خود است. این تست به روشهای مختلفی انجام میپذیرد که رایج ترین نوع آن الایزای مستقیم است. در این روش ابتدا آنتی ژن به یک سطح جامد متصل شده و سپس نمونه مجهول که حضور و یا عدم حضور آنتی بادی مورد نظر درون آن مورد بررسی است روی این سطح جامد اضافه میشود. سپس آنتی بادی ثانویه که متصل به آنزیم HRP است بدان افزوده شده و در نهایت سوبسترای آنزیم (TMB) بدانها افزوده میشود، پس از گذشت 15 دقیقه واکنش متوقف گردیده و رنگ حاصل شده توسط دستگاه ELISA Reader خوانده میشود.
مراحل انجام آزمایش به صورت زیر است:
1- جذب آنتی ژن به بستر جامد (پوشش دهی)
2- شستشو (جداکردن واکنش دهندههای متصل شده از متصل نشده)
3- بلوکه کردن
4- افزودن نمونه (آنتی بادی اول)
5- انکوباسیون
6- شستشو
7- افزودن آنتی بادی ثانویه دارای آنزیم HRP
8- انکوباسیون
9- شستشو
10- افزودن سوبسترای آنزیم TMB
11- انکوباسیون
12- افزودن H2SO4 20% (متوقف کردن واکنش)
13- خواندن دانسیته نوری (OD) توسط دستگاه ELISA Reader
وسترن بلات
مقدمه
از ایمونوبلاتینگ برای شناسایی پروتئینهای اختصاصی از طریق آنتی بادیهای منوکلونال یا پلیکلونال استفاده میشود، در این روش نمونههای پروتئین در حضور دترجنت یونی سدیم دودسیل سولفات (SDS) و عوامل احیاء کننده (مثل 2- مرکاپتواتانل یا دی تیوتریتول) الکتروفورز میگردند، سپس پروتئینها از ژل به غشاء نیترو سلولز یا غشاء نایلونی انتقال داده میشوند و با استفاده از آنتی بادیهای نشاندار شناسایی میگردند.
روشهای انتقال
برای انتقال پروتئینها از ژل به غشاء از دو روش استفاده میشود، روش تانک یا روش الکتروبلاتینگ و روش نیمه خشک. در روش انتقال با تانک، نمونه حاوی بافر تریس-گلیسین و متانول از ژل به کاغذ نیتروسلولز انتقال داده میشود که در این روش متانول علاوه بر اینکه از تورم ژل جلوگیری میکند باعث جدا شدن SDS از پروتئینها شده و بازده اتصال پروتئین به غشاء را افزایش میدهد، گاهی اوقات به منظور افزایش بازده انتقال، مقدار 02/0 درصد SDS به بافر تانک اضافه میشود. اضافه نمودن مقدار زیاد اتانول و SDS به بافر تانک بازده انتقال پروتئین به غشاء را کاهش میدهد. در روش انتقال نیمه خشک، ساندویچ انتقال پس از خیس شدن در بافر انتقال، بین دو الکترود بزرگ گرافیتی قرار گرفته و عمل انتقال انجام میگیرد، لذا این روش نیاز به مقدار بسیار کمی بافر داشته و عمل انتقال نیز سریعتر انجام میگیرد.
رنگ آمیزی اختصاصی غشاء نیترو سلولز با استفاده از آنتیبادی
در این روش معمولاً از آنتی بادیهای نشاندار شده با مواد رادیواکتیو، فلورسانس و آنزیمها از قبیل پراکسیداز، آلکالین، فسفاتاز استفاده میشود. این روش بر پایه واکنش آنتی بادی- آنتی ژن استوار است و به طور اختصاصی یک پروتئین خاص در غشاء نیتروسلولز شناسایی و رنگ آمیزی میگردد که این روش تحت عنوان ایمونوبلاتینگ نامیده میشود.
در این روش ممکن است از دو آنتی بادی استفاده شود، آنتی بادی اولیه و آنتی بادی ثانویه. آنتی بادی ثانویه، آنتی بادیی است که علیه آنتی بادی اولیه ساخته میشوند، این عمل باعث میشود تعداد لایههای رنگ افزایش یافته و شدت رنگ در ناحیه مورد نظر افزایش یابد (روش غیر مستقیم)، میتوان فقط از یک نوع آنتی بادی اولیه نشاندار استفاده کرد (روش مستقیم)، که در این حالت فقط یک لایه رنگ خواهیم داشت.
Multiscreen Apparatus (Manifold)
به کمک Mini-PROTEAN II multiscreen میتوان به راحتی در یک بار وسترن 20 آنتی بادی مختلف را روی یک نمونه بررسی کرد. برای هر چاهک فقط 550 میکرو لیتر از نمونه کافیست.
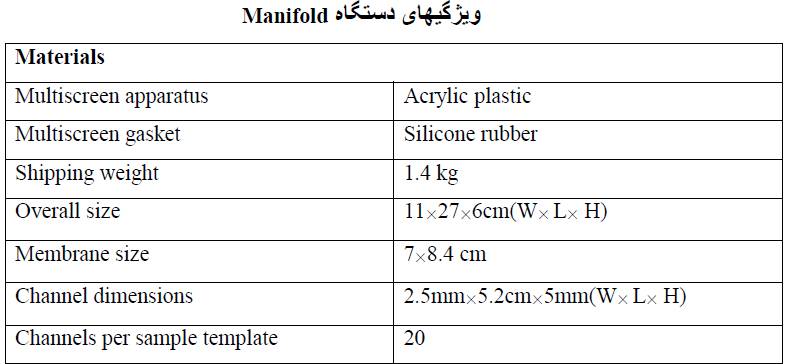
در این روش پس از الکتروفورز، وسترن بلات و انتقال ژل به کاغذ نیتروسلولزی، ابتدا Multiscreen Apparatus را شستشو داده و خشک مینماییم. پس sealing gasket را روی پایه Mustiscreen Apparatus گذاشته (بطوریکه سطح برجسته آن بداخل باشد) پس کاغذ membrane را پس از بلوکه شدن (طبق روش وسترن بلات) روی آن تنظیم میکنیم. سپس Sample template را روی کاغذ بلات گذاشته و 4 پیچ آنرا محکم میبندیم.
بوسیله سمپلر 1ml در هر چاهک µl550 نمونه رقیق شده وارد میکنیم. انتقال آرام نمونه به داخل چاهک برای جلوگیری از آمیختگی محتویات 2 چاهک و تشکیل نشدن حباب بسیار لازم و ضروری است. پس از وارد کردن نمونه (آنتی بادی اول) و پر شدن هر چاهک از یک نوع آنتی بادی، به مدت 2 ساعت روی شیکر قرار میگیرد. ادامه این تکنیک همانند وسترن بلات میباشد.



 مقاله نقشه یابی مولکولی صفات گیاهان زراعی
مقاله نقشه یابی مولکولی صفات گیاهان زراعی توی پنجره دوجداره
توی پنجره دوجداره باردهی درختان ميوه به چه عواملی بستگی دارد
باردهی درختان ميوه به چه عواملی بستگی دارد آموزش جدا کردن پاجوش های آلوئه ورا
آموزش جدا کردن پاجوش های آلوئه ورا اطلاعات کامل درخت گلابی در ایران
اطلاعات کامل درخت گلابی در ایران معرفی گل درختچه ها آپارتمانی زیبا سازی باغچه
معرفی گل درختچه ها آپارتمانی زیبا سازی باغچه روش کاشت پیاز سنبل
روش کاشت پیاز سنبل شيره خام شيره پرورده درخت چیست
شيره خام شيره پرورده درخت چیست گل کراسولا دانستنی های آن
گل کراسولا دانستنی های آن